Все населяющие организм человека бактерии – хорошие и плохие – называются микробиотой. В одном только кишечнике живет до 100 триллионов микробов, которые находятся в симбиотических, то есть, взаимовыгодных, отношениях со своим хозяином. Благодаря исследованиям, проводимым по всему миру (и проекту Human Microbiome Project), теперь мы знаем, что их коллективный геном, по крайней мере, в 100-150 раз больше нашего (1, 2, 8).
Связь между кишечной микрофлорой и здоровьем известна уже более века (3), но ученые долгое время не имели возможности выделить и описать всю популяцию кишечных бактерий. Только недавно были разработаны методы прямого секвенирования микробиома, благодаря чему мы узнали, что бактерии могут влиять на разные процессы в организме, в том числе – на потребление энергии и ее траты (4).
Микрофлора кишечника может сильно отличаться по размеру и составу как между разными людьми, так и у одного человека в течение жизни: на это может влиять возраст, питание, лекарства, изменения веса и общее метаболическое здоровье. В свою очередь, разные субпопуляции кишечной микрофлоры вырабатывают сигнальные молекулы, которые могут влиять на энергетический баланс, метаболизм и вес тела (5, 6). Уже накопилось много исследований на грызунах, которые показывают: микробиота кишечника – чувствительный энтероэндокринный “орган”, который может участвовать в развитии ожирения и сопутствующих заболеваний вроде диабета, и когда-нибудь сможет использоваться в терапевтических целях.
Микрофлора кишечника очень разнообразна, не все еще изучено, но основными бактериями, выраженными в процентном отношении к общей популяции, являются:
- Bacteroidetes (20–25%)
- Firmicutes (60–65%)
- Proteobacteria (5–10%)
- Actinobacteria (3%)
Все вместе, эти типы составляют более 97% популяции кишечных микробов.
Раньше считалось, что внутриутробная среда стерильна, и колонизация новорожденного бактериями начинается только в момент его рождения. Но сегодня известно, что создание микробной популяции кишечника у новорожденного – сложный процесс взаимодействия между генотипами матери и плода, его внутриутробной жизнью, питанием матери, наличием у нее аллергии, приемом антибиотиков, типом родов (естественными или через кесарево сечение), питанием матери и ребенка после родов (12).
Например, прием антибиотиков женщиной во втором и третьем триместрах беременности связан со снижением бактериального разнообразия стула новорожденного, уменьшением количества лактобацилл и бифидобактерий в кишечнике и, согласно наблюдательным исследованиям, даже повышенным риском ожирения в будущем (13, 14, 15).
Дети, рожденные естественным образом, колонизируются вагинальными и кишечными бактериями матери, а дети, родившиеся с помощью кесарева сечения, первоначально колонизируются бактериями с кожи матери (16, 14).
У недоношенных детей первоначально развивается менее разнообразная микробиота, с преобладанием Proteobacteria и Firmicutes по сравнению с Bacteroidetes (17, 18). И независимо от срока родов, рожденные через кесарево сечение дети имеют менее разнообразную микрофлору, которая содержит абсолютно и относительно меньшие популяции Bacteroides и Bifidobacteria (19), что сохраняются от нескольких месяцев до нескольких лет (20). Схожую микробную картину имеют взрослые люди с ожирением (21), поэтому ученые предполагают, что микрофлора рожденных через кесарево детей может быть причиной увеличения рисков ожирения в будущем на ±40% (14, 22, 23). Но нужно помнить, что это результат наблюдательных исследований, которые показывают связь двух переменных, без причин и следствий.
Хотя генетика и может влиять на микробиоту человека, особенно первые годы жизни (это показывают исследования на близнецах), дальше это играет совсем небольшую роль, по сравнению с тем, как на микрофлору влияет окружающая среда – питание, климат, география и другие факторы (22, 23, 24). Например, есть исследования, которые используют многомерный анализ для сравнения индустриальных обществ, таких как США или Европа, с традиционными обществами, такими как охотники-собиратели хадза из Танзании (25) или аборигены Папуа-Новой Гвинеи (26). Они показывают, что индустриализация связана с меньшим разнообразием фекальных бактерий внутри отдельных индивидуумов и бОльшим разнообразием между людьми.
Энергетический гомеостаз
В нормальных условиях поступление энергии с едой и ее траты в течение дня подстраиваются друг под друга – это позволяет сохранять относительно постоянный уровень запасенной в жире энергии (27, 28). Недоедание/голодание и поддержание сниженной массы тела заставляют организм включать механизмы адаптации и экономии. Во-первых, снижаются траты энергии в течение дня: становится более активной парасимпатическая нервная система, что проявляется замедлением сердечного ритма, снижением артериального давления и расхода энергии в покое за счет снижения выработки гормонов щитовидной железы (29, 30).
Во-вторых, человек чувствует голод острее, получает больше удовольствия от еды, дольше не чувствует насыщения и хуже оценивает количество съеденного. Все это толкает есть больше, чтобы восстановить запасы энергии – и краткосрочные, и долгосрочные в виде жира. Исследования показывают, что эти сигналы не снижаются со временем даже у однажды похудевших людей, которые стараются поддерживать новый вес. Как результат, многие набирают его обратно (31, 32, 33, 34, 35, 36, 37, 38, 39, 40).
Все эти адаптации находятся под управлением гормона лептин, который вырабатывается жировыми клетками и действует непосредственно на рецепторы в головном мозге через вегетативную нервную и нейроэндокринную системы.

Исследования на грызунах
У нас есть много исследований влияния микрофлоры кишечника на энергетический баланс, но практически все контролируемые исследования проведены на грызунах.
Два наиболее распространенных типа бактерий в кишечнике – Bacteroidetes и Firmicutes. У генетически страдающих ожирением мышей относительная доля Bacteroidetes снижена, а Firmicutes – увеличена (7), в отличие от стройных мышей. Это показывает, что ожирение само по себе изменяет состав бактерий. Потеря веса так же влияет на разнообразие и соотношение бактерий в кишечнике.
Питание влияет и на состав, и на разнообразие бактерий в кишечнике. Так, диета с высоким содержанием полисахаридов приводит к большему разнообразию бактерий (8). А диета с большим количеством жиров у обычных мышей, а так же устойчивых к ожирению при помощи генной инженерии, приводит к значительному снижению Bacteroidetes, независимо от скорости набора веса (9).
Изменения микрофлоры влияют и на энергетический гомеостаз у грызунов. Например, лабораторные мыши, лишенные с самого рождения бактерий в кишечнике, хуже усваивают еду и хуже получают из нее энергию. Заселение их кишечника бактериями от «обычных» мышей (в сочетании с обычной мышиной диетой без перекармливания или недокармливания) приводит к набору веса тела до того же уровня, что имеют мыши-доноры (10).
А мыши, получившие микрофлору от доноров с ожирением, содержащую более высокие абсолютные и относительные количества Firmicutes, набрали в два раза больше жира, чем мыши, получившие бактерии от “нормальных” доноров. Интересно, что в обоих вариантах мыши ели примерно одинаково, и никакой значительной разницы в потреблении энергии между ними не было, поэтому ученые предполагают, что причина – в повышении эффективности извлечения энергии из еды (11).
Другие исследования показывают, что роль играет и состав диеты. Стерильные мыши, получившие бактерии от мышей с ожирением, набирали больше веса, чем те, кто получил бактерии от устойчивых к ожирению доноров, но эффект этот был только при питании с высоким содержанием жиров.
Прежде чем переносить результаты исследований на людей, важно понимать, что системы энергетического гомеостаза у людей и мышей в некоторых моментах принципиально разные.
Во-первых, отличается типичная диета: в мышиной больше углеводов и меньше жира. Во-вторых, отличаются ночные и суточные биоритмы, связанные с потреблением энергии и ее расходом. В-третьих, самые серьезные различия – в количестве бурого и белого (обычного) жира в теле: у мышей намного больше бурого, и на него приходится >50% их метаболизма, а у людей – менее 5% (41, 42). У мышей на количество бурого жира и его метаболизм влияет как состав рациона, так и бактерии кишечника (43, 44), вот почему на мышиный энергетический гомеостаз микрофлора влияет намного больше. Об этом нужно помнить, прежде чем переносить результаты исследований по бактериям напрямую на человека.
А что у людей?
Сегодня мы знаем, что состав микрофлоры кишечника и ее разнообразие реагируют на:
- вес тела и количество жира;
- историю изменений веса (человек страдал ожирением и похудел или никогда ожирением не страдал);
- состав рациона и количество поступающей энергии – дефицит калорий или поддержание веса (45, 46, 47, 48, 49).
Но пока неясно, что влияет больше всего (50). В будущем исследования изменений в микрофлоре кишечника после липосакции ответят на вопрос более точно, ведь при этой операции человек худеет без диеты и без отрицательного энергетического баланса.
Как микрофлора кишечника влияет на вес
Ученые предлагают несколько механизмов, с помощью которых бактерии потенциально могут влиять на вес тела.
1. Усвоение энергии из еды (energy harvest)
Заселение кишечника стерильных мышей обычными мышиными бактериями приводит к увеличению веса, несмотря на то, что эти мыши начинают меньше есть и больше двигаться (51, 52, 53). Предполагается, что дело – в повышении эффективности усвоения энергии из еды.
Пока точно не ясно, что именно позволяет стерильным мышам поддерживать более низкий вес (и более низкий уровень запасов энергии), чем тот, который организм будет «защищать» после заселения кишечника бактериями и набора веса. Интересно, что заселение толстых мышей бактериями худых доноров не только приводит к потере веса, но еще и, по-видимому, не включает адаптацию организма на потерю запасов энергии. При обычном похудении, как было написано выше, именно это и происходит, а при заселении толстых мышей бактериями от худых и похудении в результате этого – нет. Когда мы точно поймем механизмы, это можно будет использовать для разных манипуляций с питанием, лекарствами и другими вмешательствами, которые повлияют на микробиом и снизят усвоение энергии из еды у людей (54, 55).
Пока известно, что более эффективное извлечение энергии из еды связано с увеличением Firmicutes и уменьшением Bacteroidetes (53). В одном исследовании изучали влияние диеты с дефицитом калорий (2400 ккал/день) и переедания (3400 ккал/день) на микрофлору 12 стройных людей и 9 человек с ожирением. И при переедании, и при ожирении в кишечнике было больше Firmicutes и меньше Bacteroidetes. При недоедании, а так же у стройных людей – наоборот (50). То же исследование показало, что увеличение количества Firmicutes на 20% и соответствующее уменьшение Bacteroidetes связано с увеличением усвоения энергии из еды на ~150 ккал/день или ~5% от потребляемых калорий.
Механизмы, с помощью которых микрофлора может влиять на усвоение энергии из еды, остаются пока гипотетическими. Из исследований на грызунах известно, что на это влияет длительность воздействия еды на слизистую оболочку кишечника: сокращение или увеличение времени прохождения еды по кишечнику приводило, соответственно, к увеличению численности Bacteroidaceae и Porphyromonadaceae (56).

Про пересадку бактерий
Учитывая, что толстых мышей можно сделать худыми, а худых – толстыми, изменив их микробиоту, появилась гипотеза, что пересадка бактерий стройного человека людям с ожирением может помочь в снижении веса, как это происходит у мышей. Предыдущие исследования таких пересадок людям показали улучшение инсулинорезистентности в печени у пациентов с метаболическим синдромом (это заболевание – частый спутник ожирения). Но недавно появилось первое контролируемое исследование людей с ожирением, не имеющих параллельно сопутствующих ожирению болезней. Оно было представлено на Digestive Disease Week в 2019 году.
“В нашей клинике мы видим пациентов, которые не имеют никаких других медицинских проблем и просто не могут похудеть. Это очень важная популяция, которой мы хотели уделить внимание и попытаться помочь понять причины”, – сказала Джессика Аллегретти, доктор медицинских наук, ведущий автор исследования и директор программы трансплантации фекальной микробиоты.
В этом исследовании приняли участие 22 пациента с ожирением, но без диабета, проблем с печенью и других сопутствующих ожирению заболеваний. Во время 12-недельного исследования половина принимала капсулы, содержащие фекалии стройного донора, а другая половина – плацебо (пустышку) в виде идентичных по виду капсул. Кроме потери веса, ученые искали изменения в глюкагоноподобном пептиде 1 (GLP1) – гормоне, который вырабатывается в кишечнике и связан с ощущением сытости, а через это – с увеличением или потерей веса.
По окончании исследования разницы в гормоне GLP1 и потере веса в обеих группах не было. Но ученые обнаружили другие изменения в микробиоте участников, получивших фекалии в капсулах. Среди них – снижение специфической желчной кислоты и бактериальные изменения в образцах стула, которые стали более схожи со стройными донорами.
И хотя формально исследование по пересадке микрофлоры стройных людей не показало никаких значимых результатов, ученые не унывают. “Наше исследование делает обнадеживающий первый шаг в попытке понять роль микрофлоры кишечника в ожирении метаболически здоровых людей. Мы надеемся, что в будущем это поможет более целенаправленной терапии”. Дальше ученые планируют делать более чувствительные измерения GLP1, проводить дополнительные исследования с разными дозами фекального материала и искать другие механизмы, чтобы лучше понять роль микробиоты в ожирении. “Данные о желчной кислоте, безусловно, интригуют и показывают, что, возможно, есть несколько разных путей, ведь ожирение – сложное, многофакторное заболевание”, – говорит доктор Аллегретти.
2. Улучшение чувствительности к лептину
Лептин – важный гормон, который управляет весом тела и долгосрочным энергетическим балансом. Он вырабатывается жировыми клетками и сообщает мозгу о том, сколько в организме запасено энергии. Когда лептина много, мозг понимает, что в организме достаточно жира (энергии). Как результат, нет сильного голода, а скорость обмена веществ на хорошем уровне (5). Когда лептина мало, это сигнал, что и жировых запасов (энергии) мало, что означает голод и возможную смерть. В результате обмен веществ снижается, а голод растет, чтобы запасы энергии были увеличены. Таким образом, главная роль лептина — долгосрочное управление энергетическим балансом (6).
Грызунам с дефицитом лептина давали пробиотики для снижения количества Firmicutes и увеличения Bacteroidetes, что привело к повышению чувствительности мозга к лептину (57). Это позволяет предположить, что кишечная микрофлора может влиять на передачу сигналов лептина в гипоталамус. При этом, ситуация может быть и обратная: вырабатываемые бактериями сигнальные молекулы могут подавлять пути, с помощью которых мозг реагирует на лептин. Дефицит лептина или плохая чувствительность рецепторов головного мозга к нему приводит к набору веса, потому что человек начинает чувствовать постоянный голод, плохо насыщается и становится менее активным физически.

3. Уменьшение системного воспаления
Повышение циркулирующих в крови воспалительных цитокинов было предложено в качестве механизма, с помощью которого высокожировая диета приводит к ожирению (58, 59). Это может быть связано с повышенной экспрессией в толстой и подвздошной кишке липополисахаридов, которые также могут выделяться и кишечными бактериями (NF-kB и TNFa) (60, 61).
Еще ученые предпологают, что выработка бактериями кишечника, а также клетками подвздошной и толстой кишки эндотоксинов приводит к метаболической эндотоксемии, которая действует на гипоталамус и вызывает переедание, а также увеличивает проницаемость кишечника для питательных веществ (62, 63). Было обнаружено, что ситуация улучшается при лечении антибиотиками.
4. Выработка жирных кислот с короткой цепью
Пищевые волокна овощей, фруктов, круп и бобовых являются пребиотиками – питанием для полезных бактерий, поддерживающим их рост и активность (64). Например, небольшие количества фруктоолигосахаридов инулинового типа, вводимых человеку, стимулируют рост Bifidobacterium, Lactobacillus, Roseburia и Faecalibacterium, особенно полезных для здоровья (65).
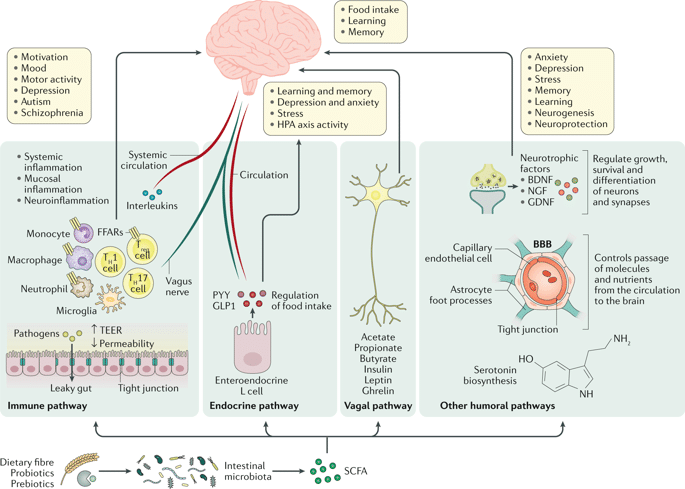
Бактерии метаболизируют (ферментируют) волокна, поступающие с углеводами, в короткоцепочечные жирные кислоты (SCFA, short chain fatty acids) – ацетат, бутират и пропионат. Они служат источником энергии для эпителия толстой кишки (бутират), гепатоцитов (пропионат) и других периферических тканей (67), и могут влиять на энергетический баланс. Например, при участии SCFA уменьшается высвобождение воспалительных цитокинов (68), что может косвенно повышать чувствительность гипоталамуса к лептину (69, 70).
Разные SFCA влияют на вес по-разному. Например, бутират улучшает насыщение, что связывают с повышением уровня “гормонов сытости” – глюкагоноподобного пептида 1 и пептида YY, которые вырабатываются в кишечнике и действуют на центр насыщения в гипоталамусе, а еще принимают участие в гомеостазе глюкозы (66). Пропионат так же влияет на метаболизм глюкозы, а у мышей он снижает потребление пищи и повышает двигательную активность (72). Введение ацетата увеличивает высвобождение лептина жировыми клетками, а так же имеет анорексигенный (снижающий аппетит) эффект, что может быть заметно на высокоуглеводной диете.
Кроме того, SCFA способны преодолевать гематоэнцефалический барьер и проникать в головной мозг, взаимодействуя напрямую с центром насыщения в гипоталамусе. Ученые обнаружили, что они увеличивают синтез и высвобождение глутамата, гамма-аминомасляной кислоты и проопиомеланокортина и снижают выработку повышающих аппетит пептидов в гипоталамусе (71).
Выводы
Исследования на грызунах показывают, что бактерии кишечника влияют на потребление энергии, ее усвоение из еды и ее расход. Предполагается, что-то похожее может быть и у человека, и что манипуляции микрофлорой могут стать потенциальным терапевтическим вмешательством для лечения ожирения. Но пока данных мало, и нужны дальнейшие исследования на людях с манипуляциями пребиотиками (волокнами), пробиотиками (самими бактериями) и составом диеты. А пока еще рано давать какие-либо рекомендации по “микробной терапии” при ожирении.
Так же нужны исследования изменений микрофлоры с помощью прямой пересадки, питания, приема про- или пребиотиков у людей с разными соматотипами (с ожирением, похудевшими или никогда не имевшими лишнего веса). Это поможет найти специфические поведенческие, микробные и метаболические фенотипы, которые смогут предсказывать реакцию людей на разные подходы к похудению – поведенческие, лекарственные, про- и пребиотические или хирургические.
Все усложняет еще и то, что микрофлора кишечника влияет на другие системы, вовлеченные в ожирение, включая гомеостаз глюкозы и липидов, системное воспаление и прочее (74), поэтому, опять же, нужно больше исследований на людях.
Пока все гипотезы о влиянии бактерий на вес человека основаны на:
- Исследованиях на животных. Но эти результаты – для ученых, они служат отправной точной для построения разных гипотез и будущих исследований на людях, а не для плана действий и не для громких заголовков в интернете.
- Косвенных измерениях: ученые меняют кишечную флору и изучают ее влияние на отдельные молекулы, влияющие на выработку и потребление энергии, без прямых измерений всех переменных в единой системе.
Источник: Handbook of Obesity Treatment, Second Edition, by Thomas A. Wadden, George A. Bray (2018).
Перевод: fitlabs.ru
***
Так что никаких конкретных рекомендаций по лечению ожирения с помощью микрофлоры ученые не дают, хотя и признают, что область очень перспективная, а мы пока просто мало знаем. Из тех советов, что они могут дать сейчас: следите за весом и ешьте больше овощей, что вроде бы и не новость.